Imagine uma reação simples.
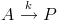
Onde A é o reagente, e P é o produto. A cinética dessa reação dirá, basicamente, como a sua velocidade varia com as muitas variáveis possíveis: natureza química dos reagentes, concentração dos reagentes, temperatura, presença de luz, presença de catalisador etc.
A velocidade da reação
Para a reação simples mencionada acima, a velocidade da reação será a velocidade de consumo do reagente que, neste caso, será igual à velocidade de geração do produto[1]. Assim:
Onde [A] é a concentração de A, e [P] é a concentração de P. O sinal negativo vem do fato de A estar sendo consumido, ou seja, desaparecendo do meio reacional. Sua variação de concentração será negativa, fazendo com que a velocidade seja positiva, sempre.
É muito importante que você perceba que o fato de o termo v, a velocidade da reação, supondo que a sua lei de velocidade não seja de ordem zero (veja mais adiante), depender da concentração, significa que conforme o tempo passa e o reagente é consumido, a velocidade da reação vai diminuindo. A velocidade a que nos referimos é a velocidade instantânea de reação, não a média.
A velocidade média da reação é simplesmente a divisão da quantidade de reagente que foi consumido (ou de produto que foi formado, no caso da reação simples mencionada) por um intervalo de tempo.
 Já a velocidade instantânea é a taxa de variação da concentração de reagente em um determinado instante de tempo. (Hã? Pergunte a um matemático, senão esse post vai ficar ainda maior.)
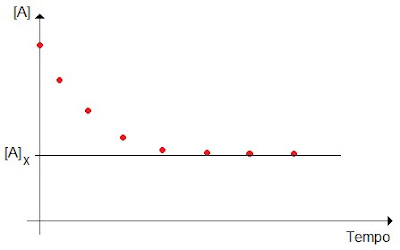
Já a velocidade instantânea é a taxa de variação da concentração de reagente em um determinado instante de tempo. (Hã? Pergunte a um matemático, senão esse post vai ficar ainda maior.)Um perfil comum da curva de variação da concentração do reagente com o tempo está representado a seguir. Quando o tempo é longo o suficiente, a concentração tende a um valor limite, [A]x, que pode ser zero ou não, dependendo de em que composição do meio reacional a energia livre será mínima.
Deve-se notar que a expressão de velocidade deve levar em consideração os coeficientes estequiométricos da reação. Por exemplo, para a reação:
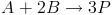 Qual será a velocidade? Pra isso, basta pensar nas proporções. A velocidade será a própria velocidade de consumo de A. Porém, para cada vez que reage, 2 moléculas de B são consumidas para cada A. Ou seja, se medirmos simplesmente a velocidade de consumo de B, estaremos medindo o dobro da velocidade real. A velocidade será então a metade da velocidade de consumo de B. Ainda, quando reagem, 3 moléculas de P são produzidas. Ou seja, a velocidade será um terço da velocidade de produção de P. Como a reação é uma só, todas essas velocidades são iguais.
Qual será a velocidade? Pra isso, basta pensar nas proporções. A velocidade será a própria velocidade de consumo de A. Porém, para cada vez que reage, 2 moléculas de B são consumidas para cada A. Ou seja, se medirmos simplesmente a velocidade de consumo de B, estaremos medindo o dobro da velocidade real. A velocidade será então a metade da velocidade de consumo de B. Ainda, quando reagem, 3 moléculas de P são produzidas. Ou seja, a velocidade será um terço da velocidade de produção de P. Como a reação é uma só, todas essas velocidades são iguais.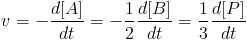
A lei de velocidade e a ordem de reação
Tentar estudar a cinética de uma reação dependendo de todas as variáveis citadas no início seria um inferno se tivéssemos que considerar tudo variando ao mesmo tempo. Então o que se faz é fixar todas as outras variáveis e deixar apenas uma livre. Geralmente, se deixa a concentração dos reagentes variando, e se fixa o resto.A letra k acima da seta é a chamada constante de velocidade da reação. Nela estão embutidas justamente todas as outras variáveis que foram fixas. Dessa forma, k é uma função da natureza dos reagentes, temperatura, presença de luz, presença de catalisador etc.
Assim, a velocidade da primeira reação mencionada no texto será dada por sua lei de velocidade:
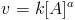
Onde [A] é a concentração do reagente A, e a é a ordem de reação com relação a A. Ou seja, se a=1, a reação é de primeira ordem com relação a A, se for 2, é de segunda etc. Não necessariamente a será um número inteiro. Pode também ser fracionário. (1/2; 3/2...) Existe também a ordem global de reação, que é, respirem, a soma dos expoentes dos termos de concentração da lei de velocidade. Complicado? Não, muito simples. Por exemplo, para uma reação:
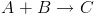
E supondo que sua lei de velocidade seja:
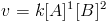
A ordem global de reação será 1+2=3, ou seja, a reação é de ordem 3. É possível que uma reação tenha ordem zero. Ou seja, nesse caso:
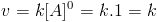
E a velocidade da reação independe da concentração de seus reagentes. Portanto, sua velocidade é constante.[2]
Outro ponto importante é a relação entre a ordem de reação com relação a uma espécie e seu coeficiente estequiométrico. Não necessariamente eles serão iguais. As ordens de reação só serão iguais aos coeficiente estequiométricos se o processo químico for elementar [3], ou seja, se ele ocorrer em apenas uma etapa, sem a geração de intermediários. Se o processo
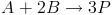
for elementar, então:
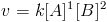
Também é perfeitamente possível que uma lei de velocidade não tenha ordem de reação definida, tanto global quanto com relação a uma espécie. Por exemplo, para a reação
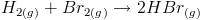 que não é um processo elementar, a lei de velocidade, determinada experimentalmente, é bem feia[4]:
que não é um processo elementar, a lei de velocidade, determinada experimentalmente, é bem feia[4]: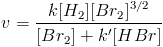 Percebe-se que a reação é de ordem 1 com relação a H2, mas fica bem complicado, senão impossível, determinar qual a ordem com relação às outras espécies, e até a ordem global.
Percebe-se que a reação é de ordem 1 com relação a H2, mas fica bem complicado, senão impossível, determinar qual a ordem com relação às outras espécies, e até a ordem global.A lei de velocidade de uma reação é determinada experimentalmente, e geralmente não pode ser deduzida da equação da reação química. Os métodos utilizados para a sua determinação não serão explicados aqui, simplesmente porque seria necessária uma quantidade horrorosa de páginas para isso.
Cenas do próximo capítulo...
A lei de Arrhenius e suas aplicações mais estranhas...
Notas
[1] No caso de uma reação que ocorra em mais de uma etapa, a velocidade da reação será basicamente expressa pela velocidade da etapa mais lenta. (Veja nota [3])
[2] Somente as reações heterogêneas (cujo meio reacional não é monofásico) podem ter ordem global zero.
[3] Um processo não elementar seria, por exemplo:
 onde A, B e C são reagentes, I é uma espécie intermediária e P é o produto
onde A, B e C são reagentes, I é uma espécie intermediária e P é o produto[4] k e k' são constantes de velocidade de certas etapas da reação. Cada etapa da reação é geralmente dada como uma etapa elementar.

Nenhum comentário:
Postar um comentário